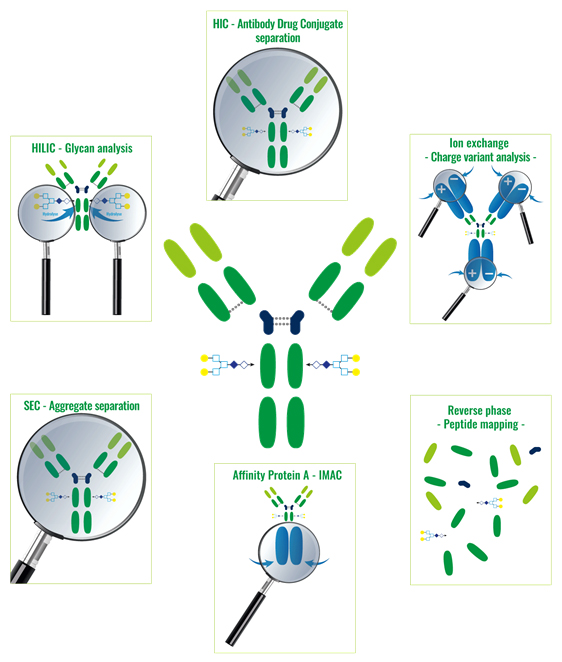
La technique HIC est également connue sous le nom de “Salting out”. La séparation se fait suivant l’hydrophobicité des molécules. Dans un tampon salin donné, les molécules seront éluées par ordre croissant d’hydrophobicité.
Toutes les protéines présentent des domaines hyrdophobes et des domaines hydrophiles. La présence de sel va exposer les domaines hydrophobes. Chargées dans une colonne de HIC (colonne remplie d’une résine hydrophobe), la molécule est retenue. En appliquant un gradient d’élution de force ionique diminuant, les molécules sont éluées.
Cette technique dépend du sel utilisé, de sa concentration, du pH, de la température et des additifs.
Les ligands de la résine hydrophobes sont le plus souvent des groupements Ether, Béthyl ou Phényl.
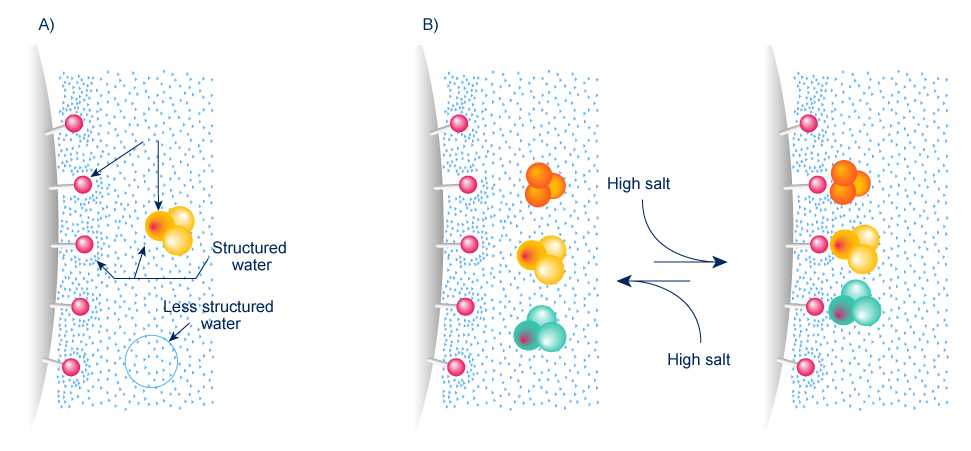
A) En contact de groupements hydrophobes l’eau est parfaitement structurée : les parties hydrophobes ne peuvent se lier.
B) Le sel détruit la structure de l’eau : les groupements hydrophobes se lient.
Principe de la séparation
- Les protéines présentent des réions hydrophobes et des régions hydrophiles.
- En tampons aqueux de faibles concentration saline (faible force ionique), les molécules sont entourées par une fine couche de molécules d’eaux arrangées.
- En grande concentration saline, la solvatation des protéines diminue, les régions hydrophobes sont exposées et donc la protéine peut être adsorbée sur une résine hydrophobe.
Caractéristiques
- Les molécules sont séparées par ordre croissant d’hydrophobicité
- Le pouvoir résolutif est limité
- La quantité de sel nécessaire est très importante (~ 2 M ammonium sulfate)
- La phase stationnaire ne doit pas être trop hydrophobe (Ligand C4 en faible concentration)
Facteurs influents
1. Ligand & degré de substitution
2. Concentration & type de sels – Série de Hofmeister
3.pH
Augmentation du pH : les interactions hydrophobes décroissent, probablement parce que plus de sites chargés apparaissent, la molécule est donc plus hydrophile.
Baisse du pH : les interactions hydrophobes augmentent, la molécule étant plus hydrophobe.
4. Température
Globalement les interactions hydrophobes augmentent lorsque la température augmente. Ceci est dû à l’effet entropique et aux forces de Van der Waals.
Cependant la protéine peut être dénaturée, sa solubilité en solution est modifiée et conduit à sa précipitation.
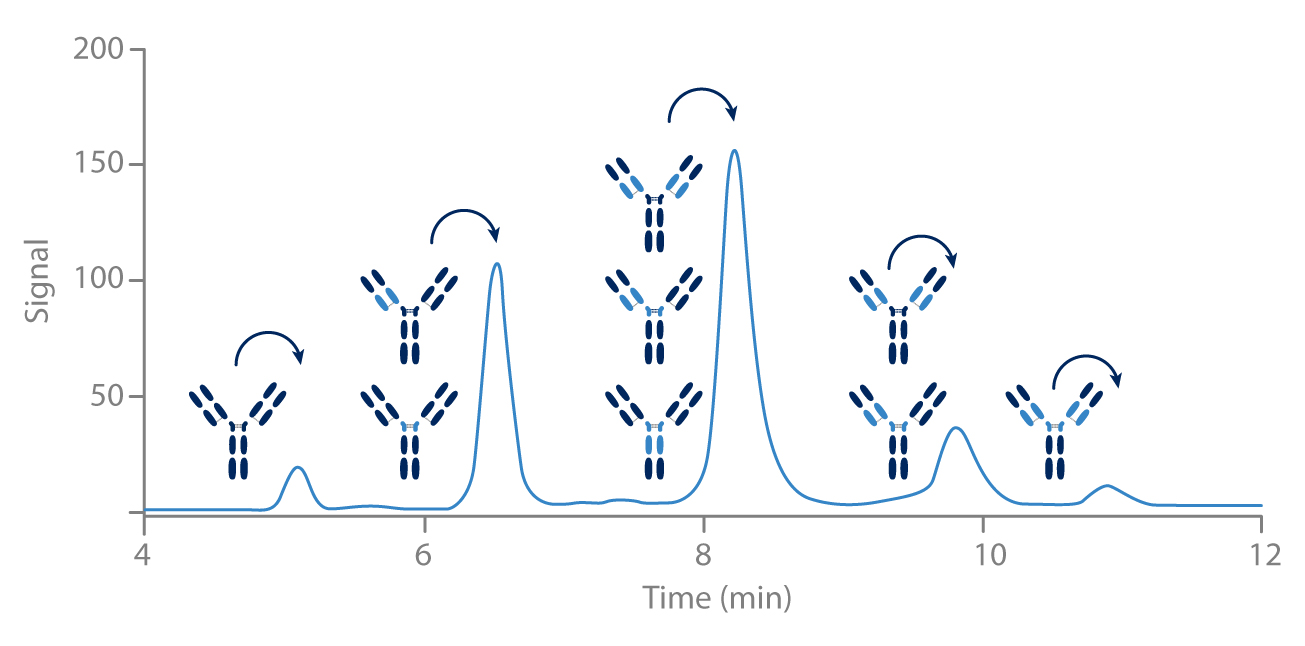
HIC pour les ADCs
La technique HIC est particulièrement bien adaptée aux purifications des ADC (Antibody Drug Conjugate).
Les ADCs sont des complexes d’anticorps monoclonaux sur lesquels sont liés de façon stable des molécules cytotoxiques biologiquement actives.
La conjugation peut être sur les acides amines :
- Cysteine (e.g. Brentuximab Vedotin)
- Lysine (e.g. Trastuzumab Emtansin)
Plus de 50 ADC sont en tests cliniques.
La séparation est basée sur le nombre de molécules cytotoxiques liées à l’anticorps.
A. Beck et al., Disc. Medicine, 2010, 10, 329-339
En savoir plus :
- Contactez-nous : interfine@interchim.com
- Rendez-vous sur notre site web : www.interchim.com
- Nos précédents articles sur les techniques de purification des protéines :
– Guide : Techniques d’analyse et de purification des molécules biologiques
– Analyse & purification des protéines : tout sur la chromatographie par échange d’ions (IEX)
– Analyse & purification des protéines : tout sur la chromatographie par affinité
– Analyse & purification des protéines : SEC, la séparation des molécules selon leurs tailles